Алгоритм визначення
валентності за хімічними формулами речовин, що складаються з двох елементів
1. Записують хімічну формулу речовини і розставляють валентності над знаками тих елементів, які виявляють
постійну або відому валентність:
а) якщо елемент виявляє змінну
валентність, то вона обов'язково вказується в назві речовини;
б) Хлор,
Бром та Йод з Гідрогеном і
металами завжди одновалентні;
в) Сульфур з Гідрогеном і
металами завжди двовалентний;
г) Нітроген
і Фосфор з Гідрогеном і металами
завжди тривалентні;
д) Карбон
і Силіцій з Гідрогеном і
металами завжди чотиривалентні.
I
II
FeCl
Cl O
2. Обчислюють
спільне число валентностей (найменше спільне кратне - НСК). Для цього
поставлену валентність множать на індекс біля хімічного елемента.
I
II
FeClз
Cl2O7
НСК = I • 3 = 3 НСК = II • 7 = 14;
3. Обчислюють валентність елемента з невідомою
валентністю. Для цього НСК ділять на індекс цього хімічного елемента
III I
|
|
3:1 = III (валентність Fe)
|
FeClз
|
VII II
|
|
14:2 = VII (валентність СІ)
|
Cl2O7
|
Алгоритм складання
хімічних формул речовин, що містять два елементи, за валентністю
Сульфур
(VI) оксид Фосфор
(V) оксид.
1. Поряд записують знаки хімічних
елементів, що входять до складу речовини, у такому порядку:
а) метал завжди записується на
першому місці;
б) з двох неметалів на першому місці
пишеться той елемент, який у назві формули читається першим;
в) в оксидах на другому місці завжди
записують Оксиген.
SO
PO
2. Над знаками хімічних елементів
записують їхні валентності.
I II V II
S O
P O
3. За розставленими валентностями
вираховують загальне число (найменше спільне кратне - НСК)
валентностей, як правило, шляхом перемножування валентностей.
VI II
|
V II
|
НСК = S
O = 6;
|
НСК=
P O =5•2=10
|
4. Поділом загального
числа валентностей на валентність відповідного хімічного елемента
розраховують його індекс у хімічній формулі. Індекс «1» у хімічній формулі
не пишуть.
6 : 6 = 1 (індекс біля S)
6 : 2 = 3 (індекс біля О) → SO3
10 : 5 = 2 (індекс біля P)
10 : 2 = 5 (індекс біля О) → P2O5
Алгоритм складання хімічних рівнянь.
1) Складають хімічну схему реакції:
а) Зліва
записують формули вихідних речовин (реагентів), тобто речовин, що
вступають у хімічну реакцію.
б)
Записують знак «→».
в) Справа записують
формули продуктів реакції, тобто речовин, що утворюються в результаті хімічної
реакції.
2) Будь-яке хімічне рівняння має відповідати закону
збереження мас речовин. Тобто загальна кількість атомів кожного хімічного
елемента до і після реакції має бути однаковою. Для цього необхідно розставляти
коефіцієнти:
а) коефіцієнти завжди ставлять тільки перед
формулами (не можна ставити коефіцієнти в середині хімічних формул: 2Н2О,
а не Н220);
б) починати зрівнювати треба з елемента, атомів якого
більше;
в) якщо присутній елемент у парному та непарному стані,
то елемент з непарним числом атомів подвоюють, тобто перед формулою ставлять
цифру 2;
г) зрівнювання атомів здійснюють шляхом обчислення
загального числа атомів, а потім поділу загального числа атомів на індекси.
3) Перевіряють правильність розстановки коефіцієнтів. Замінюють → на =.
Вчимося складати хімічні рівняння.
1) Скласти хімічне рівняння реакції
взаємодії алюмінію з киснем, внаслідок якої утворюється алюміній оксид:
а) Схема реакції: Al + O2 → Аl2O3
б) Зрівнюємо число атомів Оксигену до
шести ( 6 - НСК кількості Оксигену до і після реакції O2 →O3): Al + 3O2 → 2Аl2O3
в)
Зрівнюємо число атомів Алюмінію до чотирьох: 4Al + 3O 2 → 2Аl2O3
Завдання
1. Визначити
валентності в таких речовинах:
N2O, ClO2, P2O5, Fe2O,
NH3, Cl2O, NO
2. Скласти формули сполук за валентністю
III III III
III
|
IV II
|
Al S, N O, N H, Fe Cl,
|
N O, Pb
O
|
3. Скласти рівняння реакцій за поданими схемами.
a) Al + S → Al2S3
б) СH4 → С + Н2
в) Zn + О2 → ZnO
г) Li + О2 → Li2O
ґ) HgO → Hg + О2
д) H2S + О2 → Н2O + SO2
е) АІ + НСІ → АІС13 + Н2
є) К + Н2O → КОН + Н2
4. Скласти формули речовин, що утворюються в результаті даних реакцій. Розставити коефіцієнти.
III II
|
|
а) Р + S →
|
Р S
|
IV
|
|
б) CaCO3 →
|
CaO + С О
|
IV
|
|
в) Si + O2 →
|
Si О
|
V
|
|
г) H3PO4 →
|
PO +
H O
|
8 клас
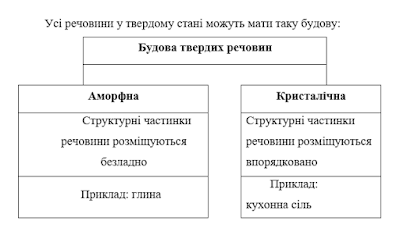
Структурну
впорядкованість кристалічних речовин називають кристалічними гратками.
Кристалічна ґра́тка - геометрично правильне
розташування атомів (йонів, молекул), властиве речовині, яка перебуває в
кристалічному стані.
Ø Класифікація кристалічних ґраток.
Залежно від
природи частинок, що містяться у вузлах кристалічної гратки, і від того, які
сили взаємодії між ними переважають розрізняють атомні, йонні, металічні та молекулярні кристалічні гратки.
Міцність
кристалічної гратки залежить від її типу. Пояснюється це видом зв’язків у
різних кристалічних речовинах.
Типи кристалічних граток
З таблиці видно, що на початку періодів розташовані металічні елементи, що утворюють прості речовини з кристалічною граткою.
Завершують кожний період неметалічні елементи, що утворюють прості речовини з молекулярною кристалічною граткою.
Елементи, що розташовані в середині періоду (як металічні, так і неметалічні) утворюють прості речовини з атомною кристалічною граткою.
Масова частка розчиненої речовини.
1.
У воді масою 155 г розчинили плюмбум(ІІ) нітрат масою 45 г.
Обчисліть масову частку солі в розчині.
2.
2. Обчисліть, яку масу калій
перманганату треба взяти, щоб приготувати дезінфікуючий розчин масою 80 г з масовою часткою
солі 0,012.
3.
3. До розчину калій нітрату масою 160 г з масовою часткою
солі 40% долили воду масою 240 г. Обчисліть масову частку солі в новому
розчині.
4.
. До розчину масою 50 г з масовою часткою барій хлориду 0,3
долили розчин цієї ж солі масою 150 г з масовою часткою 0,6. Обчисліть масову
частку солі в новому розчині.
Дисоціація кислот, основ, солей.
Складання повних і скорочених йонних рівнянь
реакцій
І варіант
Завдання 1. Напишіть
рівняння дисоціації речовин, поданих формулами:
MgCl2, Н3Р04,
NH4OH, HF,
Ва(ОН)2, Hg(NO3)2.
Завдання 2. Напишіть молекулярні, повні та
скорочені йонні рівняння реакцій між попарно взятими речовинами. Поясніть, чому
вони відбуваються до кінця.
a) Na2CO3 та НСl;
б) ZnCl2 та КОН;
в) ZnCO3 та HBr;
г) NaOH та HNO3;
і) Сu(ОН)2 та НСІ;
II варіант
Завдання 1. Випишіть окремо катіони та аніони з
даного переліку:
ClO3- Mg2+, Сl-,
ОН-,
Na+, Al3+, SO42-, Fe2+, СO32-, Н+,
Hg2+, Br-, СаОН+,
S2-, Cu2+, Fe3+, NO3-.
Завдання 2. Напишіть
рівняння дисоціації речовин, поданих формулами:
HNO3, КОН, АlСl3, Sr(OH)2, НВг, К3РO4.









Немає коментарів:
Дописати коментар